Pengenalan kepada ACE2
ACE2 adalah glikoprotein transmembran yang menyahaktif secara efektif hormon angiotensin II (AngII), satu hormon perantara keradangan, dengan menukarkannya kepada heptapeptida angiotensin 1-7, hormon-hormon yang mempunyai ciri-ciri anti-radang1-2. ACE2 juga dapat menukar (tetapi secara kurang efektif) hormon angiotensin I, prekursor kepada hormon AngII, kepada angiotensin 1-9, dan peptida biologikal yang lain3. Kini, walaupun secara amnya peranan biologikal ACE2 cenderung ke arah positif (iaitu anti-radang), ACE2 lebih terkenal dengan peranan negatifnya sebagai protein pintu masuk ke dalam sel manusia bagi SARS-CoV-2. Terdahulu, ACE2 telah diketahui mempunyai peranan yang serupa bagi beberapa koronavirus lain seperti SARS-CoV dan HCoV-NL634-7. Ibarat “kunci” kepada “mangga”, salah satu protein di virus (“kunci”) hanya sesuai dengan salah satu protein di sel manusia (“mangga”). Perkara ini mula direkod pada tahun 2003, dimana saintis menemui ACE2 adalah mangga kepada SARS-CoV5. Dengan kemunculan SARS-CoV-2, para saintis mengkaji samada ACE2 juga memainkan peranan sebagai “mangga” virus ini dan telah mendapati bahawa sebenarnya spike glikoprotein pada SARS-CoV-2 adalah pasangan “kunci” yang lebih sesuai kepada “mangga” ACE2 berbanding SARS-CoV terdahulu.
ACE2 & risiko COVID-19
Risiko COVID-19 yang paling ketara adalah faktor umur dimana orang muda mempunyai risiko rendah berbanding golongan tua untuk mendapat simptom teruk penyakit ini. Dari segi jantina pula, keberangkalian untuk golongan lelaki mendapat simptom teruk COVID-19 adalah tiga kali lebih tinggi berbanding wanita. Antara teori paling munasabah yang telah dicadangkan adalah sekiranya terdapat lebih banyak ACE2, maka terdapat lebih banyak pintu masuk SARS-CoV-2 yang kemudiannya boleh mengakibatkan beban virus yang lebih tinggi (Gambarajah 1 dan 2). Pada masa ini, ekspresi ACE2 pada sel manusia belum disahkan berada pada tahap yang lebih tinggi dalam golongan warga tua. Melihat faktor jantina pula, kandungan ACE2 sememangnya tinggi pada kelenjar testis, dan gen yang mengekod protein ACE2 sebenarnya terletak pada kromosom X, di mana wanita mempunyai dua salinan tetapi lelaki hanya mempunyai satu salinan sahaja.
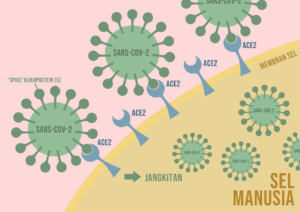
Gambarajah 1: SARS-CoV-2 menjangkiti sel manusia dengan memasuki sel melalui “pintu masuk” ACE2. Spike Glikoprotein (S) merupakan kunci kepada “mangga”(reseptor) yang terdapat di ACE2.
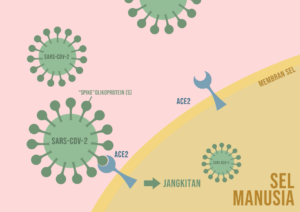
Gambarajah 2: SARS-CoV-2 sukar menjangkiti sel manusia apabila “pintu masuk”/ACE2 kurang diekspresi.
Teori alternatif di mana ekspresi ACE2 boleh menyumbang kepada jangkitan SARS-COV-2 yang lebih teruk datangnya dari struktur protein ACE2 ini. Struktur ACE2 serupa dengan lebih 1000 jenis protein sel yang terdapat di sel membrane, dimana protein tersebut mempunyai satu hujung di dalam sel dan sebahagian besar protein tersebut di luar sel. Dan bahagian luar protein-protein sel ini boleh tersingkir dan dilepaskan ke dalam saluran darah. Menariknya, bahagian protein ACE2 yang di luar sel mengandungi “mangga” SARS-CoV-2. Antara enzim proteolitik yang dijumpai dapat melepaskan bahagian luar protein ACE2 dari permukaan sel adalah ADAM178. Sekiranya “kunci” SARS-CoV-2 terikat kepada “mangga” yang tidak lagi terikat ke sel membran, SARS-CoV-2 mungkin sukar menjangkiti sel-sel saluran pernafasan walaupun terdapat ACE2 yang masih mempunyai “mangga” SARS-CoV-2 di permukaan sel membran tersebut. Dan jika kadar bahagian luar ACE2 disingkirkan berlaku dengan cepat kerana terdapat ekspresi ADAM17 yang tinggi, SARS-CoV-2 mungkin tidak dapat menjangkiti sel tersebut kerana tiada bahagian luar protein yang menjadi “mangga” kepada SARS-CoV-2 (Gambarajah 3).
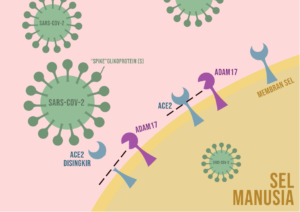
Gambarajah 3: ADAM17 merupakan enzim proteolitik yang mampu membebaskan “mangga” yang terdapat di ACE2 daripada terikat ke sel membran.
ACE2 dan lain-lain penyakit
Menariknya, ACE2 yang telah disingkirkan kedalam saluran darah telah didapati meningkat dalam keadaan patologi seperti tekanan darah tinggi, sakit kardiovaskular, obesiti dan, kencing manis (sakit diabetes)9. Ekspresi gen enzim proteolitik ADAM17 juga telah didapati meningkat dengan kehadiran AngII yang mungkin meningkatkan proses penyingkiran ACE2 dari membran sel10. Meta-analisis tujuh kajian dengan jumlah pesakit COVID-19 sebanyak 1,576 telah mendapati bahawa jangkitan teruk penyakit COVID-19 lebih cenderung berlaku pada penghidap tekanan darah tinggi, penyakit pernafasan dan, sakit kardiovaskular, sementara analisis kes COVID-19 terbesar dari laporan Pusat Kawalan dan Pencegahan Penyakit China yang mengkaji 44,672 kes kematian telah mendapati 10.5% menghidapi penyakit kardiovaskular, 7.3% menghidapi diabetes, 6.3% menghidapi penyakit pernafasan kronik dan, 6% menghidapi tekanan darah tinggi11-12.
Persamaan ketara di antara keadaan patologi yang meningkatkan kadar penyingkiran ACE2 dan faktor risiko untuk menghidapi penyakit COVID-19 yang parah serta kematian yang disebabkan oleh COVID-19 seolah-olah satu paradoks kerana sepatutnya jika lebih banyak ACE2 disingkirkan kedalam saluran darah, maka terdapat pengurangan ekspresi ACE2 pada sel yang sepatutnya mengurangkan jumlah pintu masuk SARS-CoV-2 ke dalam sel manusia. Ini mungkin boleh dijelaskan jika modulasi AngII menggunakan ubat perencat enzim penukar angiotensin (ACEI) dan penghalang reseptor angiotensin (ARB), yang kebanyakkannya digunakan untuk merawat tekanan darah tinggi dan sakit kardiovaskular, meningkatkan ekspresi ACE2 didalam sel. Perkara ini telah diperhatikan berlaku dalam beberapa kajian menggunakan model haiwan dimana ekspresi ACE2 meningkat apabila ubat-ubat ACEI dan ARB menyekat AngII. Contohnya, dalam model tikus yang mengalami kegagalan jantung, ACEI enalapril memulihkan ekspresi ventrikular kiri ACE213. Begitu juga, bagi model tikus yang mengalami infarksi miokardium atau serangan jantung, ARB losartan dan olmesartan meningkatkan ekspresi ACE2 mRNA di dalam hati14. Kesan ini juga ditemui didalam tikus yang mempunyai jantung yang sihat, di mana ARB losartan dan ACEI lisinopril meningkatkan ekspresi gen ACE215. Ini telah mendorong spekulasi bahawa keadaan abnormal ACE2 disebabkan oleh rawatan terdahulu kepada keadaan patologi seperti tekanan darah tinggi, sakit kardiovaskular, dan, sakit diabetes mungkin menjadi penyebab peningkatan kadar risiko jangkitan SARS-CoV-2.
Kesimpulan
Merenung kembali, ACE2 seolah-olah dicipta untuk menanti kedatangan Covid-19 dan SARS sebelumnya. Namun, ACE2 didalam badan menusia bukannya dicipta sebagai portal untuk jangkitan virus tetapi merupakan satu enzim yang menyahaktifkan AngII, yang mempunyai pelbagai peranan yang bermanfaat, tetapi akan mengakibatkan kesan yang negatif kepada badan jika tidak dinyahaktif selepas menjalankan peranan-peranan tersebut. Menariknya, beberapa kesan negatif AngII mempunyai ciri yang sama dengan jangkitan COVID-19, terutamanya di dalam paru-paru, seperti radang paru-paru, radang endothelium, dan peningkatan thrombosis16-23. Beberapa eksperimen yang berkaitan dengan kecederaan paru-paru juga menunjukkan terdapat hubungan di antara ekspresi ACE2 dan radang paru-paru yang boleh dikaitkan dengan ketidakseimbangan antara AngII yang berlebihan dan Angiotensin 1-7 yang berkurangan24-27. Kajian ini disokong oleh satu eksperimen yang mengkaji pesakit COVID-19, yang menemui beban virus dan kecederaan paru-paru berkait rapat dengan kepekatan AngII didalam saluran darah28.
Oleh itu, berkemungkinan, pada peringkat awal jangkitan, kandungan ACE2 yang rendah di permukaan sel-sel paru-paru mengurangkan risiko sel tersebut dijangkiti, akan tetapi apabila sel paru-paru sudah terjangkit, kandungan ACE2 yang tinggi mungkin melindungi paru-paru daripada kesan negatif AngII. Ini mungkin dapat menerangkan perbezaan ketara keparahan penyakit COVID-19 antara minggu pertama dan minggu-minggu yang seterusnya. Kesimpulannya, pada peringkat awal, ACE2 berperanan sebagai musuh kerana membenarkan SARS-CoV-2 menjangkiti sel paru-paru. Tetapi selepas dijangkiti, ACE2 adalah rakan kerana boleh menyahaktifkan peningkatan AngII yang disebabkan oleh jangkitan.
Ditulis oleh:
Dr Elena Azizan
Jabatan Perubatan, Pusat Perubatan Universiti Kebangsaan Malaysia, Kuala Lumpur, Malaysia
Dr Norlela Sukor
Jabatan Perubatan, Pusat Perubatan Universiti Kebangsaan Malaysia, Kuala Lumpur, Malaysia
Dr Morris Brown
Pusat Penyelidikan Bioperubatan Kardiovaskular NIHR Barts dan Institut Penyelidikan William Harvey, Queen Mary University of London, United Kingdom
Rujukan
- Donoghue, M., Hsieh, F., Baronas, E., Godbout, K., Gosselin, M., Stagliano, N., Donovan, M., Woolf, B., Robison, K., & Jeyaseelan, R. (2000). A novel angiotensin-converting enzyme–related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circulation Research, 87(5), e1-e9.
- Tipnis, S. R., Hooper, N. M., Hyde, R., Karran, E., Christie, G., & Turner, A. J. (2000). A human homolog of angiotensin-converting enzyme cloning and functional expression as a captopril-insensitive carboxypeptidase. Journal of Biological Chemistry, 275(43), 33238-33243.
- Vickers, C., Hales, P., Kaushik, V., Dick, L., Gavin, J., Tang, J., Godbout, K., Parsons, T., Baronas, E., & Hsieh, F. (2002). Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase. Journal of Biological Chemistry, 277(17), 14838-14843.
- Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., Schiergens, T. S., Herrler, G., Wu, N.-H., & Nitsche, A. (2020). SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell, 181(2), 271-280.
- Li, W., Moore, M. J., Vasilieva, N., Sui, J., Wong, S. K., Berne, M. A., Somasundaran, M., Sullivan, J. L., Luzuriaga, K., & Greenough, T. C. (2003). Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature, 426(6965), 450-454.
- Walls, A. C., Park, Y.-J., Tortorici, M. A., Wall, A., McGuire, A. T., & Veesler, D. (2020). Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell, 181(2), 281-292.
- Wu, K., Li, W., Peng, G., & Li, F. (2009). Crystal structure of NL63 respiratory coronavirus receptor-binding domain complexed with its human receptor. Proceedings of the National Academy of Sciences, 106(47), 19970-19974.
- Lambert, D. W., Yarski, M., Warner, F. J., Thornhill, P., Parkin, E. T., Smith, A. I., Hooper, N. M., & Turner, A. J. (2005). Tumor necrosis factor-α convertase (ADAM17) mediates regulated ectodomain shedding of the severe-acute respiratory syndrome-coronavirus (SARS-CoV) receptor, angiotensin-converting enzyme-2 (ACE2). Journal of Biological Chemistry, 280(34), 30113-30119.
- Arendse, L. B., Danser, A. J., Poglitsch, M., Touyz, R. M., Burnett, J. C., Llorens-Cortes, C., Ehlers, M. R., & Sturrock, E. D. (2019). Novel therapeutic approaches targeting the renin-angiotensin system and associated peptides in hypertension and heart failure. Pharmacological Reviews, 71(4), 539-570.
- Xu, J., Sriramula, S., Xia, H., Moreno-Walton, L., Culicchia, F., Domenig, O., Poglitsch, M., & Lazartigues, E. (2017). Clinical relevance and role of neuronal AT1 receptors in ADAM17-mediated ACE2 shedding in neurogenic hypertension. Circulation Research, 121(1), 43-55.
- Wu, Z., & McGoogan, J. M. (2020). Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA, 323(13), 1239-1242.
- Yang, J., Zheng, Y., Gou, X., Pu, K., Chen, Z., Guo, Q., Ji, R., Wang, H., Wang, Y., & Zhou, Y. (2020). Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. International Journal of Infectious Diseases, 94, 91-95.
- Karram, T., Abbasi, A., Keidar, S., Golomb, E., Hochberg, I., Winaver, J., Hoffman, A., & Abassi, Z. (2005). Effects of spironolactone and eprosartan on cardiac remodeling and angiotensin-converting enzyme isoforms in rats with experimental heart failure. American Journal of Physiology-Heart and Circulatory Physiology, 289(4), H1351-H1358.
- Ishiyama, Y., Gallagher, P. E., Averill, D. B., Tallant, E. A., Brosnihan, K. B., & Ferrario, C. M. (2004). Upregulation of angiotensin-converting enzyme 2 after myocardial infarction by blockade of angiotensin II receptors. Hypertension, 43(5), 970-976.
- Ferrario, C. M., Jessup, J., Chappell, M. C., Averill, D. B., Brosnihan, K. B., Tallant, E. A., Diz, D. I., & Gallagher, P. E. (2005). Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation, 111(20), 2605-2610.
- Akhmerov, A., & Marbán, E. (2020). COVID-19 and the heart. Circulation Research, 126(10), 1443-1455.
- Clerkin, K. J., Fried, J. A., Raikhelkar, J., Sayer, G., Griffin, J. M., Masoumi, A., Jain, S. S., Burkhoff, D., Kumaraiah, D., & Rabbani, L. (2020). COVID-19 and cardiovascular disease. Circulation, 141(20), 1648-1655.
- Connors, J. M., & Levy, J. H. (2020). Thromboinflammation and the hypercoagulability of COVID‐ Journal of Thrombosis and Haemostasis, 18: 1559-1561.
- Grasselli, G., Zangrillo, A., Zanella, A., Antonelli, M., Cabrini, L., Castelli, A., Cereda, D., Coluccello, A., Foti, G., & Fumagalli, R. (2020). Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy. JAMA, 323(16), 1574-1581.
- Li, H., Liu, L., Zhang, D., Xu, J., Dai, H., Tang, N., Su, X., & Cao, B. (2020). SARS-CoV-2 and viral sepsis: observations and hypotheses. The Lancet, 395(10235), 1517-1520.
- Varga, Z., Flammer, A. J., Steiger, P., Haberecker, M., Andermatt, R., Zinkernagel, A. S., Mehra, M. R., Schuepbach, R. A., Ruschitzka, F., & Moch, H. (2020). Endothelial cell infection and endotheliitis in COVID-19. The Lancet, 395(10234), 1417-1418.
- Wu, C., Chen, X., Cai, Y., Zhou, X., Xu, S., Huang, H., Zhang, L., Zhou, X., Du, C., & Zhang, Y. (2020). Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Internal Medicine, 180(7):934-943.
- Xu, Z., Shi, L., Wang, Y., Zhang, J., Huang, L., Zhang, C., Liu, S., Zhao, P., Liu, H., & Zhu, L. (2020). Pathological findings of COVID-19 associated with acute respiratory distress syndrome. The Lancet Respiratory Medicine, 8(4), 420-422.
- Hung, Y.-H., Hsieh, W.-Y., Hsieh, J.-S., Liu, C., Tsai, C.-H., Lu, L.-C., Huang, C.-Y., Wu, C.-L., & Lin, C.-S. (2016). Alternative roles of STAT3 and MAPK signaling pathways in the MMPs activation and progression of lung injury induced by cigarette smoke exposure in ACE2 knockout mice. International Journal of Biological Sciences, 12(4), 454.
- Imai, Y., Kuba, K., Rao, S., Huan, Y., Guo, F., Guan, B., Yang, P., Sarao, R., Wada, T., & Leong-Poi, H. (2005). Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature, 436(7047), 112-116.
- Kuba, K., Imai, Y., Rao, S., Gao, H., Guo, F., Guan, B., Huan, Y., Yang, P., Zhang, Y., & Deng, W. (2005). A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus–induced lung injury. Nature Medicine, 11(8), 875-879.
- Lin, C.-I., Tsai, C.-H., Sun, Y.-L., Hsieh, W.-Y., Lin, Y.-C., Chen, C.-Y., & Lin, C.-S. (2018). Instillation of particulate matter 2.5 induced acute lung injury and attenuated the injury recovery in ACE2 knockout mice. International Journal of Biological Sciences, 14(3), 253.
- Liu, Y., Yang, Y., Zhang, C., Huang, F., Wang, F., Yuan, J., Wang, Z., Li, J., Li, J., & Feng, C. (2020). Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Science China Life Sciences, 63(3), 364-374.
